Das skandinavische Unternehmen Bonesupport AB hat sich auf die Produktentwicklung zur Behandlung von Knochenlücken, die durch Traumata, Infektionen, Krankheit oder verwandte Operationen verursacht wurden, spezialisiert. CERAMENT® besteht aus einer Vielzahl an röntgendichten injizierbaren osteokonduktiven und medikamentenfreisetzenden biokeramischen Produkten.
Produktsortiment:
CERAMENT® BVF (Bone Void Filler)
Cerament BVF ist ein synthetischer remodellierbarer Knochenfüllstoff zur Auffüllung von Zysten oder anderen Knochen-Hohlräumen durch Traumata.
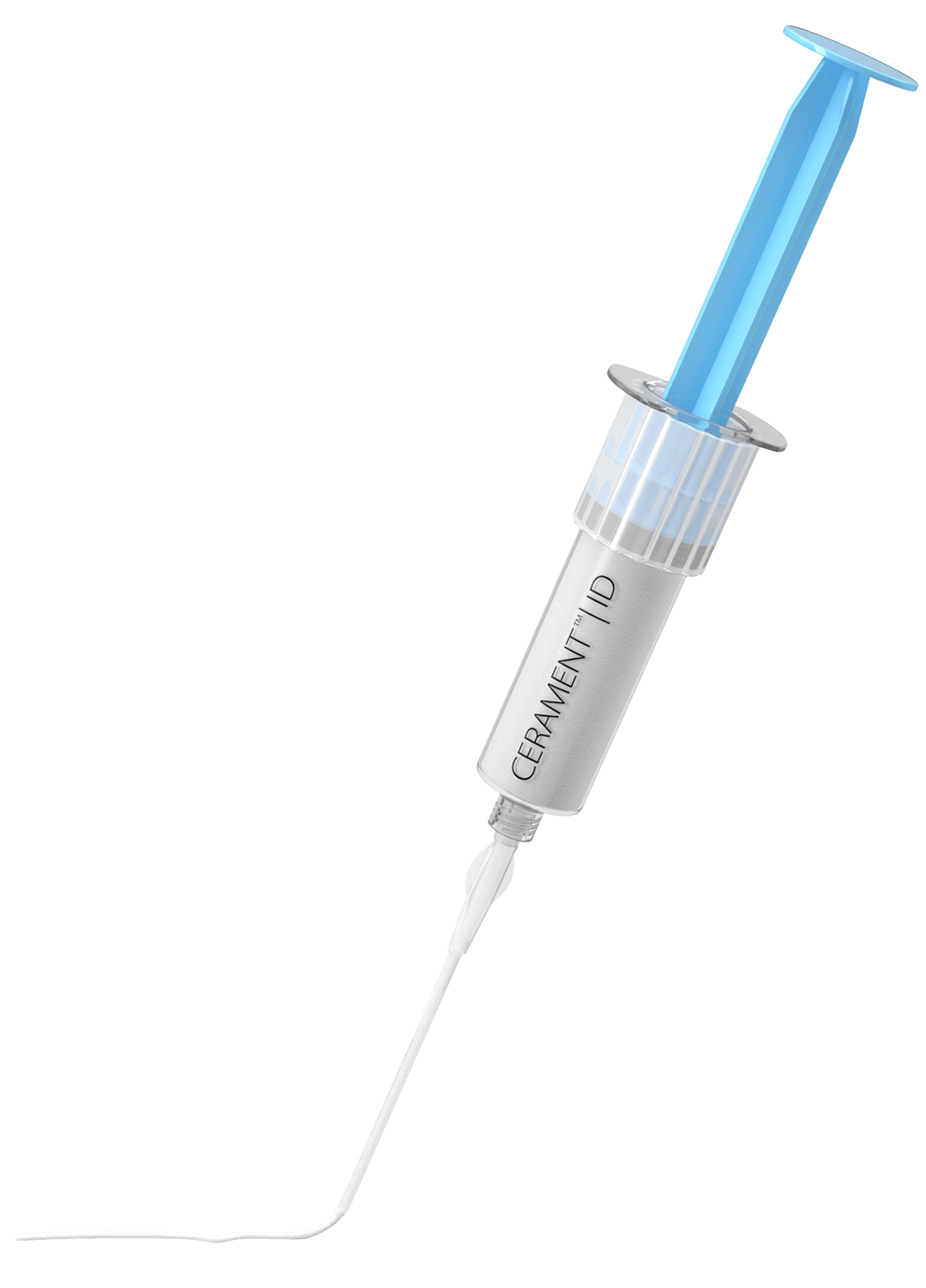
Knochenersatz bei Traumata & gutartigen Knochentumoren
Cerament wird verwendet, um Lücken und Hohlräume im Knochen zu füllen, die beispielsweise durch Traumata und gutartige Knochentumoren verursacht werden. Es handelt sich um injizier- und formbaren synthetischen Knochenersatz, der innerhalb von 6 bis 12 Monaten zum Wirtsknochen umgebaut wird. Cerament ist röntgendicht und somit ideal für minimalinvasive Operationen und offene Eingriffe. Das Material wird verwendet, um die Hardware während der Operation zu erweitern. Die einzigartige Materialkombination widersteht der Rissbildung und -ausbreitung beim Bohren.
CERAMENT® G (Gentamicin)
Cerament G ist ein synthetischer remodellierbarer Knochenfüllstoff mit hochdosiertem Gentamicin für die lokale Behandlung von Osteomyelitiden.
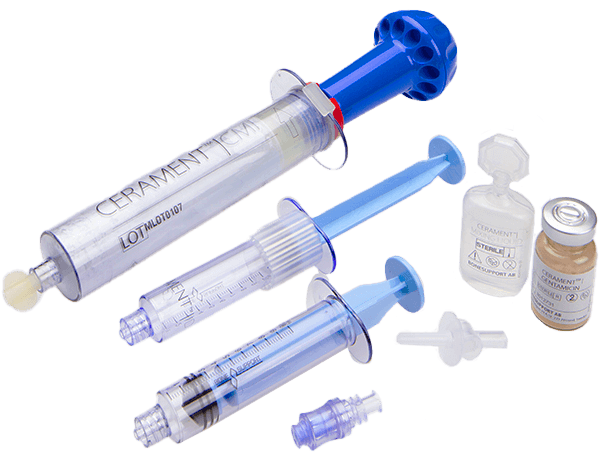
Knochenersatz bei Traumata & gutartigen Knochentumoren
Cerament wird verwendet, um Lücken und Hohlräume im Knochen zu füllen, die beispielsweise durch Traumata und gutartige Knochentumoren verursacht werden. Es handelt sich um injizier- und formbaren synthetischen Knochenersatz, der innerhalb von 6 bis 12 Monaten zum Wirtsknochen umgebaut wird. Cerament ist röntgendicht und somit ideal für minimalinvasive Operationen und offene Eingriffe. Das Material wird verwendet, um die Hardware während der Operation zu erweitern. Die einzigartige Materialkombination widersteht der Rissbildung und -ausbreitung beim Bohren.
Gentamicineluierender injizierbarer synthetischer Knochenersatz
CERAMENT | G ist der erste und einzige CE-gekennzeichnete gentamicineluierende injizierbare synthetische Knochenersatz. Das Produkt wird vorrangig bei Indikationen mit vorliegenden Infektionen eingesetzt wird.
- Gentamicin ist zuverlässig und konsitent: Die patentierte Cerament-Misch- und Injektionsvorrichtung gewährleistet eine homogene Verteilung des Antibiotikums. Die Materialeigenschaften von Cerament selbst stellen sicher, dass das gesamte Antibiotikum zur Elution zur Verfügung gestellt und kontrolliert abgegeben wird.
- Hohe Anfangskonzentration: Eine Gentamicinkonzentration über einem klinisch relevanten Zeitraum (> 28 Tage) über den MHK-Werten zu halten ist für die Wirksamkeit unabdingbar. In-vitro-Studien haben gezeigt, dass die Gentamicin-Elution aus Cerament G einen hohen Anfangspeak (> 1000 µg / ml) aufweist und min. 28 Tage über der MHK bleibt.
- Neutraler pH-Wert, um die Antibiotika-Aktivität nicht zu beeinträchtigen: Die Cerament G Paste wurde für einen neutralen pH-Wert (7,0 – 7,2) entwickelt, sodass die Antibiotika-Aktivität nicht verringert wird. Die Gentamicin-Wirksamkeit ist bei einem pH-Wert von 6,4 oder niedriger verringert.
- Hohe lokale Gentamicin-Konzentration ohne hohen Gentamicin-Serumspiegel: In-vivo-Studien haben gezeigt, dass Cerament G lokale Gentamicin-Konzentrationen aufweist, die 64-150-mal höher sind als die minimale Hemmkonzentration (MIC) für Gentamicin-sensitive Pathogene wie Staphylococcus aureus und Pseudomonas aeruginosa.
CERAMENT® V (Vancomycin)
Cerament V ist ein synthetischer remodellierbarer Knochenfüllstoff mit hochdosiertem Vancomycin für die lokale Behandlung von Osteomyelitiden.
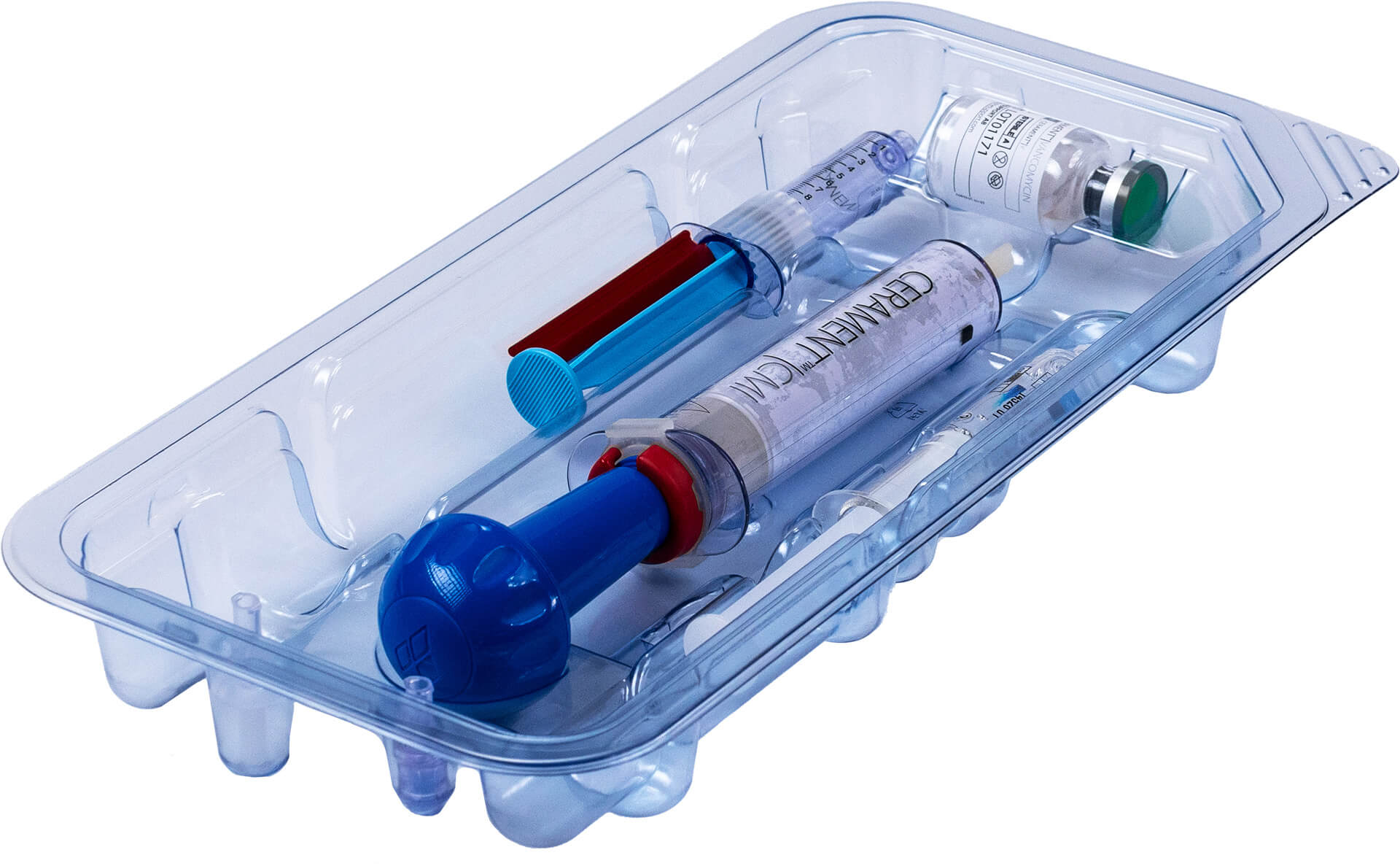
Knochenersatz bei Traumata & gutartigen Knochentumoren
Cerament wird verwendet, um Lücken und Hohlräume im Knochen zu füllen, die beispielsweise durch Traumata und gutartige Knochentumoren verursacht werden. Es handelt sich um injizier- und formbaren synthetischen Knochenersatz, der innerhalb von 6 bis 12 Monaten zum Wirtsknochen umgebaut wird. Cerament ist röntgendicht und somit ideal für minimalinvasive Operationen und offene Eingriffe. Das Material wird verwendet, um die Hardware während der Operation zu erweitern. Die einzigartige Materialkombination widersteht der Rissbildung und -ausbreitung beim Bohren.
Cerament / V enthält 66 mg Vancomycin/ml Paste sowie Lohexol für eine verbesserte Sichtbarkeit unter Durchleuchtung. Es handelt sich um den ersten und einzigen CE-gekennzeichnete Vancomycin-eluierende synthetische Knochenersatz am Markt. Das Produkt wird vorrangig bei Indikationen mit vorliegenden Infektionen eingesetzt wird.
- Vancocmycin ist zuverlässig und konsitent: Unabhängig davon, ob Cerament V injiziert, geformt oder zu Perlen geformt wird, ist das Elutionsprofil von Vancomycin das gleiche. Die patentierte Cerament-Misch- und Injektionsvorrichtung gewährleistet eine homogene Verteilung des Antibiotikums. Die Materialeigenschaften von Cerament selbst stellen sicher, dass das gesamte Antibiotikum zur Elution zur Verfügung gestellt und kontrolliert abgegeben wird.
- Neutraler pH-Wert, um die Antibiotika-Aktivität nicht zu beeinträchtigen: Die Cerament V Paste wurde für einen pH-Wert nahe dem neutralen pH-Wert (6,6 – 7,0) entwickelt, sodass die Antibiotika-Aktivität nicht verringert wird. Vancomycin ist im pH-Bereich von 6,4 bis 8 wirksam.
- Hohe Anfangskonzentration: In-vitro-Studien haben gezeigt, dass die Vancomycin-Elution aus Cerament V einen hohen Anfangspeak (> 3000 mg / l) aufweist und mindestens 28 Tage über der MHK bleibt .
- Hohe lokale Vancomycin-Konzentration ohne hohen Vancomycin-Serumspiegel: In-vitro-Studien haben gezeigt, dass Cerament V einen Vancomycin-Spiegel bietet, die bis zum 3.000-fachen der minimalen Hemmkonzentration (MIC) für Methicillin-resistenten Staphylococcus aureus (MRSA) beträgt.

